Perfluorhexan
Lidé byli vždy zvědaví na Perfluorhexan. Od starověku až po současnost byl Perfluorhexan předmětem zájmu, debat a zkoumání. Ať už prostřednictvím vědy, literatury, umění nebo historie, Perfluorhexan zanechala v lidstvu svou stopu a byla inspirací pro nespočet objevů a výtvorů. V tomto článku prozkoumáme různé aspekty související s Perfluorhexan a pokusíme se osvětlit jeho význam v naší společnosti a kultuře.
| Perfluorhexan | |
|---|---|
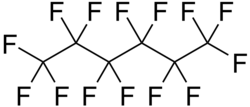 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | tetradekafluorhexan |
| Sumární vzorec | C6F14 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 355-42-0 |
| EC-no (EINECS/ELINCS/NLP) | 206-585-0 |
| PubChem | 9639 |
| ChEBI | 39427 |
| SMILES | C(C(C(C(F)(F)F)(F)F)(F)F)(C(C(F)(F)F)(F)F)(F)F |
| InChI | InChI=1S/C6F14/c7-1(8,3(11,12)5(15,16)17)2(9,10)4(13,14)6(18,19)20 |
| Vlastnosti | |
| Molární hmotnost | 338,04 g/mol |
| Teplota tání | −86,1 °C (187,0 K)[1] |
| Teplota varu | 57,2 °C (330,4 K)[1] |
| Hustota | 1,7560 g/cm3 (0 °C) 1,6910 g/cm3 (20 °C) 1,6717 g/cm3 (25 °C)[1] |
| Dynamický viskozitní koeficient | 0,979 mPa.s (0 °C)[1] |
| Index lomu | 1,2515 (20 °C)[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru[1] |
| Tlak páry | 29 kPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H315 H319 H335 H412[1] |
| P-věty | P261 P264+265 P271 P273 P280 P302+352 P304+340 P305+351+338 P319 P321 P332+317 P337+317 P362+364 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Perfluorhexan (systematicky tetradekafluorhexan) je organická sloučenina se vzorcem C6F14, perfluorovaný uhlovodík odvozený od hexanu; používá se jako chladivo a v lékařství jako kontrastní látka.
Rozpouštění kyslíku
Jelikož je perfluorhexan biologicky a chemicky netečný, tak se zkoumají jeho možná lékařská využití. Podobně jako ostatní perfluorované uhlovodíky rozpouští plyny, včetně vzdušného kyslíku, lépe než běžná organická rozpouštědla. Slabé mezimolekulové síly v molekulách perfluorhexanu poskytují dostatečný „prostor“ pro zachycení molekul plynů. Po ponoření do okysličeného perfluorhexanu mají zvířata dostatek kyslíku, aby mohl dále dýchat. Tato vlastnost se využívá při léčbě popálenin, kdy se plíce popálených plní parami perfluorhexanu nebo i kapalným perfluorhexanem, což umožňuje dále dýchat bez potíží spojených s otoky plic, jež se někdy objevují v plicích lidí popálených například po vdechování horkého kouře.[2][3]
Výzkum částečného dýchání kapaliny byl vydatně provozován zejména v 90. letech 20. století a na začátku 21. století, perfluorhexan a další perfluorované uhlovodíky ale nevykázaly žádné významné zlepšení stavu pacientů.[4]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Perfluorohexane na anglické Wikipedii.
- ↑ a b c d e f g h i j k l https://pubchem.ncbi.nlm.nih.gov/compound/9639
- ↑ M. G. De Abreu, A. D. Quelhas, P. Spieth, G. Brauer, L. Knels, M. Kasper, A. V. Pino, J. U. Bleyl, M. Hubler, F. Bozza, J. Salluh, E. Kuhlisch, A. Giannella-Neto, T. Koch. Comparative effects of vaporized perfluorohexane and partial liquid ventilation in oleic acid-induced lung injury. Anesthesiology. 2006, s. 278–289. doi:10.1097/00000542-200602000-00013. PMID 16436847.
- ↑ J. U. Bleyl, M. Ragaller, U. Tscho, M. Regner, M. Hubler, M. Kanzow, O. Vincent, M. Albrecht. Changes in pulmonary function and oxygenation during application of perfluorocarbon vapor in healthy and oleic acid-injured animals. Critical Care Medicine. 2002, s. 1340–1347. doi:10.1097/00003246-200206000-00034. PMID 12072692.
- ↑ Robert M. Kacmarek; Herbert P. Wiedemann; Philip T. Lavin; Mark K. Wedel; Ahmet S. Tütüncü; Arthur S. Slutsky. Partial Liquid Ventilation in Adult Patients with Acute Respiratory Distress Syndrome. American Journal of Respiratory and Critical Care Medicine. 2006-04-15, s. 882–889. Dostupné online. ISSN 1073-449X. doi:10.1164/rccm.200508-1196OC. PMID 16254269.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu perfluorhexan na Wikimedia Commons
Obrázky, zvuky či videa k tématu perfluorhexan na Wikimedia Commons
