Cyklobuten
V tomto článku prozkoumáme téma Cyklobuten do hloubky, zaměříme se na jeho různé aspekty, jeho dnešní důležitost a dopad v různých oblastech. Ponoříme se do jeho původu, jeho vývoje v čase a různých pohledů, které na věc existují. Podobně budeme analyzovat, jak Cyklobuten ovlivnila společnost, kulturu a každodenní životy lidí, a také její význam v globálním kontextu. V celém článku představíme různé odborné názory a relevantní studie, které čtenáři umožní ponořit se do hluboké a úplné analýzy Cyklobuten s cílem obohatit jeho porozumění a znalosti tohoto tématu.
| Cyklobuten | |
|---|---|
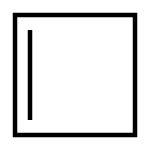 Strukturní vzorec | |
 Strukturní vzorec | |
| Obecné | |
| Systematický název | Cyklobuten |
| Sumární vzorec | C4H6 |
| Identifikace | |
| Registrační číslo CAS | 822-35-5 |
| EC-no (EINECS/ELINCS/NLP) | 212-496-8 |
| PubChem | 69972 |
| ChEBI | 51206 |
| SMILES | C\1=C\CC/1 |
| InChI | InChI=1S/C4H6/c1-2-4-3-1/h1-2H,3-4H2 |
| Vlastnosti | |
| Molární hmotnost | 54,090 g/mol |
| Teplota varu | 2 °C (275 K)[1] |
| Hustota | 0,733 g/cm3 |
Některá data mohou pocházet z datové položky. | |
Cyklobuten je organická sloučenina se vzorcem C4H6, patřící mezi cykloalkeny. Je předmětem výzkumu, ale nemá žádné praktické využití. Připravuje se dvoukrokovou dehydratací cyklobutanolu.[1]
První příprava této sloučeniny byla provedena tepelným rozkladem N,N,N-trimethylcyklobutanaminium-hydroxidu OH.[2]
Cyklobuten lze tepelně izomerizovat na buta-1,3-dien. Vysoké kruhové napětí u cyklobutenu způsobuje, že je tato reakce silně exotermní; oproti tomu u hexafluorcyklobutenu je přeměna na hexafluorbutadien značně nevýhodná.[3]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Cyclobutene na anglické Wikipedii.
- ↑ a b J. Salaün; A. Fadel. Cyclobutene. Organic Syntheses. 1986, s. 50. doi:10.15227/orgsyn.064.0050.
- ↑ R. Willstätter; W. von Schmaedel. Ueber einige Derivate des Cyclobutans. Chemische Berichte. 1905, s. 1992–1999. Dostupné online. doi:10.1002/cber.190503802130.
- ↑ David M. Lemal; Xudong Chen. The Chemistry of Cyclobutanes. Příprava vydání Zvi Rappoport, Joel F. Liebman. : , 2005. Dostupné online. ISBN 0470864001. doi:10.1002/0470864028.ch21. Kapitola Fluorinated Cyclobutanes and Their Derivatives, s. 955–1029.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Cyklobuten na Wikimedia Commons
Obrázky, zvuky či videa k tématu Cyklobuten na Wikimedia Commons